[0031] 以下对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
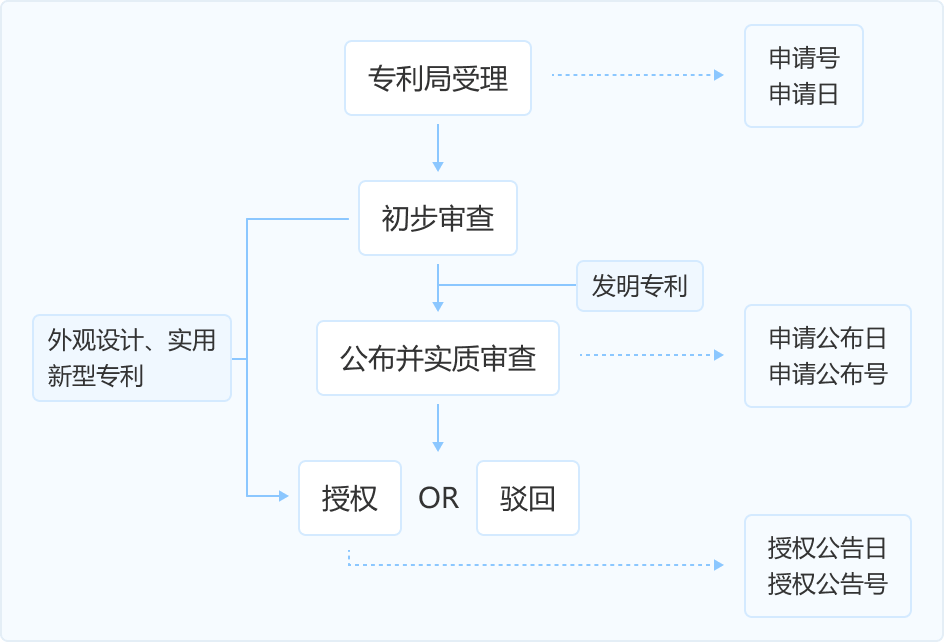
[0032] 本发明提供了一种如式(I)所示结构的顺式共轭烯炔的制备方法,包括:在保护气和有机溶剂的存在下,将如式(II)所示结构的顺式烯溴、如式(III)所示结构的端基炔、催化剂、弱碱性化合物和邻菲罗啉进行接触反应以制得如式(I)所示结构的顺式共轭烯炔,[0033]
[0034] 其中,R1为H、烷基、烷氧基、卤素或三氟甲基,R2为H、烷基、烷氧基或卤素;催化剂选自纳米氧化铜、纳米氧化亚铜和纳米碘化亚铜中的一种或多种。优选,R1为H、C1-C3的烷基、C1-C3的烷氧基、卤素或三氟甲基,R2为H、C1-C6的烷基、C1-C3的烷氧基或卤素。
[0035] 在本发明提供的制备方法,R1、R2的具体选择可以在宽的范围内选择,但是考虑到产物的产率,优选地,R1为H、甲基、甲氧基、Cl或三氟甲基,R2为H、甲基、甲氧基、戊基、乙基、Cl、Br或F;更优选地,R1为H、甲基、甲氧基或Cl,R2为H、甲基、甲氧基、Cl、Br或F;进一步优选1 2
地,R、R 均可位于2、3、4位C上;更进一步优选地,顺式共轭烯炔为顺式1-氟-4-(4-(对甲苯基)-3-丁烯-1-炔基)苯、顺式1-溴-4-(4-(对甲苯基)-3-丁烯-1-炔基)苯、顺式1-氯-4-(4-(对甲苯基)-3-丁烯-1-炔基)苯、顺式1-甲基-4-(4-苯基-1-丁烯-3-炔基)苯、顺式1-氯-2-(4-(4-对氯苯基)-3-丁烯-1-炔基)苯、顺式1-溴-4-(4-(4-对甲氧基苯基)-3-丁烯-1-炔基)苯、顺式1-氯-4-(4-(4-对甲氧基苯基)-3-丁烯-1-炔基)苯、顺式1-甲氧基-3-(4-(对甲苯基)-3-丁烯-1-炔基)苯、顺式1-溴-4-(4-(4-对氯苯基)-3-丁烯-1-炔基)苯或顺式1-氯-
4-(4-(对甲苯基)-1-丁烯-3-炔基)苯。
[0036] 在本发明中,所述催化剂的形状为梭形、球形、粒子、片状、花状;优选地,催化剂为梭形纳米氧化铜,粒径为100-250nm。
[0037] 在本发明中,弱碱性化合物的具体种类可以在宽的范围内选择,但是为了提高反应速效和产物的产率,所述弱碱性化合物选自碳酸钾、碳酸钠、碳酸氢钾、碳酸氢钠、醋酸钾、醋酸钠、磷酸钾、磷酸钠中的一种;优选地,弱碱性化合物为碳酸钾或磷酸钾。
[0038] 同时,在本发明中,有机溶剂的具体种类可以在宽的范围内选择,但是为了提高反应速效和产物的产率,优选地,有机溶剂选自二乙二醇二甲醚、N,N-二甲基甲酰胺、二甲基亚砜、1,4-二氧六环中的一种或多种。
[0039] 此外,在本发明中,保护气的具体种类可以在宽的范围内选择,但是为了提高反应速效和产物的产率,优选地,保护气为氮气、氩气中的一种。
[0040] 在上述内容的基础上,各物料的用量可以在宽的范围内选择,但是为了进一步提高产物的产率,优选地,相对于1mmol的顺式烯溴,端基炔的用量为1-1.5mmol,催化剂的用量为0.05-0.1mmol,弱碱性化合物的用量为2-4mmol,邻菲罗啉的用量为0.15-0.2mmol,有机溶剂的用量为2-10mL。
[0041] 另外,接触反应的具体条件可以在宽的范围内选择,但是为了进一步提高产物的产率,优选地,接触反应至少满足以下条件:反应温度为140-150℃,反应时间为20-24h。
[0042] 在本发明中,后处理的具体方式可以是本领域中任何一种提纯方式,但是为了提高提纯的效率和产物的常产率,优选地,在接触反应结束后,该制备方法还包括:将反应体系冷却至20-25℃,接着通过石油醚萃取2-3次,然后通过无水硫酸镁对有机相进行干燥、浓缩,最后以石油醚为展开剂进行柱层析以得到顺式共轭烯炔。
[0043] 以下将通过实施例对本发明进行详细描述。
[0044] 实施例1
[0045] 顺式1-氟-4-(4-(对甲苯基)-3-丁烯-1-炔基)苯的制备:
[0046] 分别称取0.05mmol的梭形纳米氧化铜(直径为100-250nm)、0.15mmol邻菲罗啉,2mmol碳酸钾放入洁净干燥的反应管中,将反应管放置在无水无氧体系中,抽真空并通入氩气循环三次。接着在氩气保护下再依次加入1mmol顺式1-(2-溴乙烯基)-4-甲基苯,1.2mmol的1-(4-氟-苯基)乙炔和3mL二乙二醇二甲醚。然后在140℃条件下搅拌回流20h。最后,停止反应后冷却至25℃,用石油醚萃取(3×10mL),并将所得有机相用无水硫酸镁干燥,浓缩。以石油醚作展开剂柱层析分离提纯即得白色固体,产率为90%,熔点为72-73℃。
[0047] 表征数据为:1H NMR(300MHz,CDCl3):δ7.80(d,J=7.8Hz,2H),7.48-7.43(m,2H),7.19(d,J=7.8Hz,2H),7.04(t,J=8.6Hz,2H),6.67(d,J=11.7Hz,1H),5.83(d,J=
11.7Hz,1H),2.37(s,3H);
[0048] 13C NMR(75MHz,CDCl3):δ162.9(d,J=249Hz),141.7,139.2,139.1,134.2,133.7(d,J=8.3Hz),129.9,129.4,129.1,126.6,120.1,116.1(d,J=21.8Hz),107.2,106.5,94.9,88.6,21.8。
[0049] 实施例2
[0050] 顺式1-溴-4-(4-(对甲苯基)-3-丁烯-1-炔基)苯的制备:
[0051] 分别称取0.025mmol的纳米氧化铜粒子(粒径为5-8nm)、0.075mmol邻菲罗啉、1mmol碳酸钾放入洁净干燥的反应管中,将反应管放置在无水无氧体系中,抽真空并通入氩气循环三次。在氩气保护下再依次加入0.5mmol顺式1-(2-溴乙烯基)-4-甲基苯、0.6mmol的
1-(4-溴-苯基)乙炔和2mL二乙二醇二甲醚。在140℃条件下搅拌回流20h。停止反应后冷却至25℃,用石油醚萃取(3×10mL),并将所得有机相用无水硫酸镁干燥,浓缩。以石油醚作展开剂柱层析分离提纯即得黄色固体即顺式1-溴-4-(4-(对甲苯基)-3-丁烯-1-炔基)苯,产率82%,熔点为64-65℃。
[0052] 表征数据为:1H NMR(300MHz,CDCl3):δ7.81(d,J=7.8Hz,2H),7.49(d,J=8.7Hz,2H),7.34(d,J=8.4Hz,2H),7.21(d,J=8.1Hz,2H),6.71(d,J=12.0Hz,1H),5.85(d,J=
12.0Hz,1H),2.39(s,3H);
[0053] 13C NMR(125MHz,CDCl3):δ139.6,139.2,134.2,133.2,132.1,129.4,129.1,122.9,122.9,106.4,94.8,90,21.8。
[0054] 实施例3
[0055] 顺式1-氯-4-(4-(对甲苯基)-3-丁烯-1-炔基)苯的制备:
[0056] 分别称取0.25mmol的立方体纳米氧化亚铜(粒径为200-300nm),0.75mmol邻菲罗啉,10mmol碳酸钾放入洁净干燥的反应管中,将反应管放置在无水无氧体系中,抽真空并通入氩气循环三次。在氩气保护下再依次加入5mmol顺式1-(2-溴乙烯基)-4-甲基苯,6.0mmol的1-(4-氯-苯基)乙炔和8mL二乙二醇二甲醚。在150℃条件下搅拌回流20h。停止反应后冷却至25℃,用石油醚萃取(8×10mL),并将所得有机相用无水硫酸镁干燥,浓缩。以石油醚作展开剂柱层析分离提纯即得黄色固体,产率为85%,熔点为64-66℃。
[0057] 表征数据为:1H NMR(300MHz,CDCl3):δ7.81(d,J=8.1Hz,2H),7.31-7.43(m,4H),7.21(d,J=7.8Hz,2H),6.71(d,J=11.7Hz,1H),5.85(d,J=11.7Hz,1H),2.39(s,3H);
[0058] 13C NMR(125MHz,CDCl3):δ139.5,139.2,134.7,134.2,133.0,129.4,129.2,129.1,122.5,106.4,94.7,89.8,21.8。
[0059] 实施例4
[0060] 顺式1-甲基-4-(4-苯基-1-丁烯-3-炔基)苯的制备:
[0061] 分别称取0.2mmol的颗粒状纳米碘化亚铜(粒径为20-30nm),0.6mmol邻菲罗啉,8mmol碳酸钾放入洁净干燥的反应管中,将反应管放置在无水无氧体系中,抽真空并通入氩气循环三次。在氩气保护下再依次加入4mmol顺式1-(2-溴乙烯基)-4-甲基苯,4.8mmol的1-苯基乙炔和6mL二乙二醇二甲醚。在145℃条件下搅拌回流20h。停止反应后冷却至25℃,用石油醚萃取(6×10mL),并将所得有机相用无水硫酸镁干燥,浓缩。以石油醚作展开剂柱层析分离提纯即得白色固体,产率为84%,熔点为50-52℃。
[0062] 表征数据为:1H NMR(300MHz,CDCl3):δ7.86(d,J=8.1Hz,2H),7.53-7.49(m,2H),7.35-7.38(m,3H),7.21(d,J=7.8Hz,2H),6.69(d,J=12.0Hz,1H),5.88(d,J=12.0Hz,
1H),2.39(s,3H);
[0063] 13C NMR(75MHz,CDCl3):δ141.7,139.0,138.9,134.3,131.9,131.8,129.4,129.1,128.8,128.7,128.6,126.7,123.9,110.4,106.7,96.0,88.9,21.8。
[0064] 实施例5
[0065] 顺式1-氯-2-(4-(4-对氯苯基)-3-丁烯-1-炔基)苯的制备:
[0066] 分别称取0.15mmol的梭形纳米氧化铜(直径为100-250nm),0.45mmol邻菲罗啉,6mmol碳酸钾放入洁净干燥的反应管中,将反应管放置在无水无氧体系中,抽真空并通入氩气循环三次。在氩气保护下再依次加入3mmol顺式1-(2-溴乙烯基)-2-氯苯,3.6mmol的1-(4-氯-苯基)乙炔和4mL的N,N-二甲基甲酰胺。在145℃条件下搅拌回流20h。停止反应后冷却至25℃,用石油醚萃取(5×10mL),并将所得有机相用无水硫酸镁干燥,浓缩。以石油醚作展开剂柱层析分离提纯即得黄色固体,产率为79%,熔点为51-52℃。
[0067] 表征数据为:1H NMR(300MHz,CDCl3):δ8.37(d,J=7.2Hz,1H),7.48-7.29(m,9H),7.11(d,J=12.0Hz,1H),6.05(d,J=12.0Hz,1H);
[0068] 13C NMR(75MHz,CDCl3):δ137.8,135.6,133.2,133.1,130.4,130.0,129.9,129.8,129.2,129.1,127.4,126.7,126.5,110.7,110.8,94.9,88.7。
[0069] 实施例6
[0070] 顺式1-溴-4-(4-(4-对甲氧基苯基)-3-丁烯-1-炔基)苯的制备:
[0071] 分别称取0.1mmol的片状纳米氧化铜(粒径为500-600nm),0.3mmol邻菲罗啉,4mmol碳酸钾放入洁净干燥的反应管中,将反应管放置在无水无氧体系中,抽真空并通入氩气循环三次。在氩气保护下再依次加入2mmol顺式1-(2-溴乙烯基)-4-甲氧基苯,2.4mmol的
1-(4-溴-苯基)乙炔和4mL二乙二醇二甲醚。在140℃条件下搅拌回流20h。停止反应后冷却至25℃,用石油醚萃取(3×10mL),并将所得有机相用无水硫酸镁干燥,浓缩。以石油醚作展开剂柱层析分离提纯即得黄色固体,产率为86%,熔点为69-70℃。
[0072] 表征数据为:1H NMR(300MHz,CDCl3):δ7.89(d,J=8.7Hz,2H),7.51-7.34(m,4H),6.93(d,J=8.1Hz,2H),6.68(d,J=11.7Hz,1H),5.79(d,J=11.7Hz,1H),3.85(s,3H);
[0073] 13C NMR(75MHz,CDCl3):δ160.2,139.1,133.2,132.1,130.7,129.8,122.9,122.8,114.1,104.9,94.5,90.2,55.7。
[0074] 实施例7
[0075] 顺式1-氯-4-(4-(4-对甲氧基苯基)-3-丁烯-1-炔基)苯的制备:
[0076] 分别称取0.5mmol的梭形纳米氧化铜(直径为100-250nm),1.5mmol邻菲罗啉,20mmol碳酸钾放入洁净干燥的反应管中,将反应管放置在无水无氧体系中,抽真空并通入氩气循环三次。在氩气保护下再依次加入10mmol顺式1-(2-溴乙烯基)-4-甲氧基苯,12mmol的1-(4-溴-苯基)乙炔和10mL二乙二醇二甲醚。在150℃条件下搅拌回流20h。停止反应后冷却至25℃,用石油醚萃取(10×10mL),并将所得有机相用无水硫酸镁干燥,浓缩。以石油醚作展开剂柱层析分离提纯即得黄色固体,产率为80%,熔点为55-56℃。
[0077] 表征数据为:1H NMR(300MHz,CDCl3):δ7.89(d,J=8.4Hz,2H),7.44-7.32(m,4H),6.93(d,J=8.7Hz,2H),6.67(d,J=12.0Hz,1H),5.79(d,J=12.0Hz,1H),3.86(s,3H);
[0078] 13C NMR(125MHz,CDCl3):δ160.3,139.1,134.7,133.0,130.7,129.9,129.2,122.5,114.1,105.0,94.5,90.0,55.7。
[0079] 实施例8
[0080] 顺式1-甲氧基-3-(4-(对甲苯基)-3-丁烯-1-炔基)苯的制备:
[0081] 分别称取0.8mmol的球形纳米氧化铜(粒径为20-50nm),1.6mmol邻菲罗啉,16mmol磷酸钾放入洁净干燥的反应管中,将反应管放置在无水无氧体系中,抽真空并通入氩气循环三次。在氩气保护下再依次加入8mmol顺式1-(2-溴乙烯基)-4-甲基苯,9.6mmol的1-苯基乙炔1-(3-甲氧基-苯基)乙炔和8mL二乙二醇二甲醚。在140℃条件下搅拌回流20h。停止反应后冷却至25℃,用石油醚萃取(8×10mL),并将所得有机相用无水硫酸镁干燥,浓缩。以石油醚作展开剂柱层析分离提纯即得黄色液体,产率为76%。
[0082] 表征数据为:1H NMR(300MHz,CDCl3):δ7.84(d,J=8.1Hz,2H),7.44(d,J=8.7Hz,2H),7.20(d,J=8.1Hz,2H),6.89(d,J=8.7Hz,2H),6.64(d,J=12.0Hz,1H),5.86(d,J=
12.0Hz,1H),3.84(s,3H),2.38(s,3H);
[0083] 13C NMR(125MHz,CDCl3):δ160,140.9,138.8,138.2,134.4,133.3,129.8,129.4,129.1,126.6,116.2,114.5,107.7,107.0,96.2,87.7,55.7,21.8。
[0084] 实施例9
[0085] 顺式1-溴-4-(4-(4-对氯苯基)-3-丁烯-1-炔基)苯的制备:
[0086] 分别称取0.025mmol的梭形纳米氧化铜直径为100-250nm),0.1mmol邻菲罗啉,1mmol碳酸钾放入洁净干燥的反应管中,将反应管放置在无水无氧体系中,抽真空并通入氩气循环三次。在氩气保护下再依次加入0.5mmol顺式1-(2-溴乙烯基)-4-氯苯,0.6mmol的1-(4-溴-苯基)乙炔和2mL二乙二醇二甲醚。在140℃条件下搅拌回流24h。停止反应后冷却至
25℃,用石油醚萃取(3×10mL),并将所得有机相用无水硫酸镁干燥,浓缩。以石油醚作展开剂柱层析分离提纯即得黄色固体,产率为89%,熔点为101-102℃。
[0087] 表征数据为:1H NMR(300MHz,CDCl3):δ7.84(d,J=8.4Hz,2H),7.51-7.32(m,8H),6.68(d,J=11.7Hz,2H),5.92(d,J=11.7Hz,2H);
[0088] 13C NMR(75MHz,CDCl3):δ140.7,138.1,135.2,134.6,134.2,133.3,133.2,133.0,132.2,132.0,130.3,129.4,129.2,128.9,127.9,123.2,122.5,95.7,89.3。
[0089] 实施例10
[0090] 顺式1-氯-4-(4-(对甲苯基)-1-丁烯-3-炔基)苯的制备:
[0091] 分别称取0.1mmol的花状纳米氧化铜(粒径为700-800nm),0.15mmol邻菲罗啉,2mmol碳酸钾放入洁净干燥的反应管中,将反应管放置在无水无氧体系中,抽真空并通入氩气循环三次。在氩气保护下再依次加入1mmol顺式1-(2-溴乙烯基)-4-氯苯,1.2mmol的1-(4-甲基-苯基)乙炔和3mL二乙二醇二甲醚。在150℃条件下搅拌回流20h。停止反应后冷却至25℃,用石油醚萃取(3×10mL),并将所得有机相用无水硫酸镁干燥,浓缩。以石油醚作展开剂柱层析分离提纯即得白色固体,产率为83%,熔点为51-52℃。
[0092] 表征数据为:1H NMR(300MHz,CDCl3):δ7.87(d,J=8.4Hz,2H),7.37(t,J=8.1Hz,4H),7.17(d,J=7.8Hz,2H),6.63(d,J=11.7Hz,2H),5.94(d,J=11.7Hz,2H),2.38(s,3H);
[0093] 13C NMR(75MHz,CDCl3):δ138.4,136.8,135.1,133.9,131.4,129.9,129.3,128.5,120.2,108.3,96.9,87.3,21.6。
[0094] 以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
[0095] 另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
[0096] 此外,本发明的各种不同的实施方式之间也可以进行任意组合,只要其不违背本发明的思想,其同样应当视为本发明所公开的内容。